Номер 169, страница 41 - гдз по химии 9 класс сборник задач Хвалюк, Резяпкин

Авторы: Хвалюк В. Н., Резяпкин В. И.
Тип: Сборник задач
Издательство: Адукацыя i выхаванне
Год издания: 2020 - 2025
Цвет обложки: салатовый, голубой с колбами
ISBN: 978-985-599-248-7
Допущено Министерством образования Республики Беларусь
Популярные ГДЗ в 9 классе
Глава 2. Электролитическая диссоциация. Параграф 11. Электролитическая диссоциация кислот, оснований и солей - номер 169, страница 41.
№169 (с. 41)
Условие. №169 (с. 41)
скриншот условия

169. Укажите, в каком случае с помощью водного раствора лакмуса невозможно установить, в какой из пробирок находится водный раствор каждого из двух указанных веществ:
а) $HCl$, $H_3PO_4$;
б) $KOH$, $H_2S$;
в) $Ba(OH)_2$, $BaCl_2$;
г) $H_2SO_4$, $Li_2SO_4$;
д) $HNO_3$, $NaOH$;
е) $NaCl$, $CaCl_2$;
ё) $KNO_3$, $Na_2SO_4$;
ж) $H_2SO_3$, $Na_2SO_4$.
Решение. №169 (с. 41)
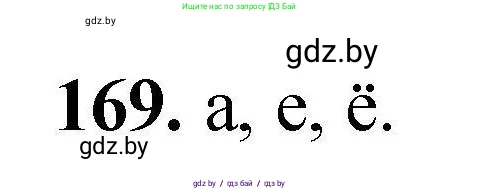
Решение 2. №169 (с. 41)
Для того чтобы определить, в каком случае невозможно различить два водных раствора с помощью лакмуса, необходимо проанализировать среду каждого раствора (кислую, щелочную или нейтральную). Лакмус является кислотно-основным индикатором, который изменяет свой цвет в зависимости от pH среды:
- В кислой среде ($pH < 7$) лакмус становится красным.
- В нейтральной среде ($pH = 7$) лакмус остается фиолетовым.
- В щелочной среде ($pH > 7$) лакмус становится синим.
Если оба раствора в паре имеют одинаковую среду (например, оба кислые), то лакмус в них покажет одинаковый цвет, и различить их будет невозможно. Проанализируем каждую пару веществ.
а) HCl, H₃PO₄
Раствор соляной кислоты ($HCl$) имеет сильнокислую среду, так как это сильная кислота. Лакмус в этом растворе станет красным.
Раствор ортофосфорной кислоты ($H_3PO_4$) также имеет кислую среду, так как это кислота (средней силы). Лакмус в этом растворе тоже станет красным.
Поскольку в обоих случаях лакмус окрасится в красный цвет, различить эти два раствора с его помощью невозможно.
Ответ: С помощью водного раствора лакмуса невозможно установить, в какой из пробирок находится водный раствор $HCl$, а в какой – $H_3PO_4$, так как оба раствора имеют кислую среду.
б) KOH, H₂S
Раствор гидроксида калия ($KOH$) имеет щелочную среду, так как это сильное основание (щелочь). Лакмус окрасится в синий цвет.
Раствор сероводородной кислоты ($H_2S$) имеет слабокислую среду, так как это слабая кислота. Лакмус окрасится в красный цвет.
Так как лакмус окрашивается в разные цвета, эти растворы можно различить.
Ответ: Растворы можно различить.
в) Ba(OH)₂, BaCl₂
Раствор гидроксида бария ($Ba(OH)_2$) имеет щелочную среду (сильное основание). Лакмус станет синим.
Раствор хлорида бария ($BaCl_2$) имеет нейтральную среду, так как эта соль образована сильным основанием ($Ba(OH)_2$) и сильной кислотой ($HCl$) и не подвергается гидролизу. Лакмус останется фиолетовым.
Так как лакмус окрашивается в разные цвета, эти растворы можно различить.
Ответ: Растворы можно различить.
г) H₂SO₄, Li₂SO₄
Раствор серной кислоты ($H_2SO_4$) имеет сильнокислую среду (сильная кислота). Лакмус станет красным.
Раствор сульфата лития ($Li_2SO_4$) имеет нейтральную среду, так как соль образована сильным основанием ($LiOH$) и сильной кислотой ($H_2SO_4$). Лакмус останется фиолетовым.
Так как лакмус окрашивается в разные цвета, эти растворы можно различить.
Ответ: Растворы можно различить.
д) HNO₃, NaOH
Раствор азотной кислоты ($HNO_3$) имеет сильнокислую среду (сильная кислота). Лакмус станет красным.
Раствор гидроксида натрия ($NaOH$) имеет щелочную среду (сильное основание). Лакмус станет синим.
Так как лакмус окрашивается в разные цвета, эти растворы можно различить.
Ответ: Растворы можно различить.
е) NaCl, CaCl₂
Раствор хлорида натрия ($NaCl$) имеет нейтральную среду (соль сильного основания $NaOH$ и сильной кислоты $HCl$). Лакмус останется фиолетовым.
Раствор хлорида кальция ($CaCl_2$) имеет нейтральную среду (соль сильного основания $Ca(OH)_2$ и сильной кислоты $HCl$). Лакмус останется фиолетовым.
Поскольку в обоих случаях лакмус не изменит свой цвет, различить эти два раствора с его помощью невозможно.
Ответ: С помощью водного раствора лакмуса невозможно установить, в какой из пробирок находится водный раствор $NaCl$, а в какой – $CaCl_2$, так как оба раствора имеют нейтральную среду.
ё) KNO₃, Na₂SO₄
Раствор нитрата калия ($KNO_3$) имеет нейтральную среду (соль сильного основания $KOH$ и сильной кислоты $HNO_3$). Лакмус останется фиолетовым.
Раствор сульфата натрия ($Na_2SO_4$) имеет нейтральную среду (соль сильного основания $NaOH$ и сильной кислоты $H_2SO_4$). Лакмус останется фиолетовым.
Поскольку в обоих случаях лакмус не изменит свой цвет, различить эти два раствора с его помощью невозможно.
Ответ: С помощью водного раствора лакмуса невозможно установить, в какой из пробирок находится водный раствор $KNO_3$, а в какой – $Na_2SO_4$, так как оба раствора имеют нейтральную среду.
ж) H₂SO₃, Na₂SO₄
Раствор сернистой кислоты ($H_2SO_3$) имеет кислую среду (слабая кислота). Лакмус станет красным.
Раствор сульфата натрия ($Na_2SO_4$) имеет нейтральную среду (соль сильного основания $NaOH$ и сильной кислоты $H_2SO_4$). Лакмус останется фиолетовым.
Так как лакмус окрашивается в разные цвета, эти растворы можно различить.
Ответ: Растворы можно различить.
Таким образом, существует три случая (а, е, ё), в которых с помощью лакмуса невозможно различить предложенные растворы, так как в каждой из этих пар оба вещества создают среду с одинаковым характером pH.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @gdz_by_belarus
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 169 расположенного на странице 41 к сборнику задач 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №169 (с. 41), авторов: Хвалюк (Виктор Николаевич), Резяпкин (Виктор Ильич), учебного пособия издательства Адукацыя i выхаванне.














